科研进展丨熵的博弈:揭示离子液体衍生物的膜攻击机制
引言
抗生素耐药性(“超级细菌”)的不断升级,已成为全球公共卫生的重大威胁,迫切需要开发具有全新作用模式的抗菌剂。离子液体衍生物(ILDs)因其能够直接破坏细菌细胞膜的物理机制,被视为一类极具潜力的新型抗菌候选药物。然而,该领域长期存在一个“长短链之谜”:实验中,时而短链ILDs展现出更高的杀菌效率,时而长链衍生物又表现出更强的抗菌活性。这种看似矛盾的现象,阻碍了对此类材料的深入理解和理性设计。
近日,松山湖材料实验室元冰研究员带领的纳米生物材料团队与苏州大学杨恺教授团队合作,通过结合分子动力学模拟、自由能计算、PCA分析和Markov态模型等多种手段,系统揭示了ILDs攻击细菌细胞膜的内在机制,成功解开了上述谜题。研究发现,ILDs的膜攻击行为由一个构象熵与构型熵之间相互竞争的“熵控开关”所主导,为设计高效、精准的新一代膜靶向抗菌剂提供了新的理论框架和指导原则。

一、核心发现:两步攻击机制与“熵控开关”
研究团队发现,不同长短链的ILDs攻击细胞膜都遵循一个普适的“两步”机制:第一步是快速吸附到细胞膜表面,第二步是深入插入膜的内部。然而,决定这两步效率的关键,在于ILDs是以单体形式还是聚集体形式与膜相互作用,而这背后则由一个精妙的“熵控开关”所调控。
🔹对于单体ILDs:其膜攻击过程由“构象熵”主导。当单个ILD分子从无序的水溶液中吸附到有序的细胞膜表面时,其柔性烷基链的构象自由度会增加,带来熵增益,从而驱动其快速结合。
🔹对于聚集体ILDs:其膜攻击过程则由“构型熵”主导。当多个ILD分子形成的聚集体与膜作用时,聚集体内部的分子排列和取向会发生变化,这种构型上的多样性同样带来熵增益,驱动整个聚集体与膜结合。
这一发现完美地解释了“长短链之谜”:
🔹短链ILDs(如ILD-6)倾向于以单体形式作用,其高效率源于构象熵驱动下的极快结合速度。
🔹长链ILDs(如ILD-12)更容易形成聚集体,其高活性则源于构型熵驱动下的高效结合与更深的插入深度。
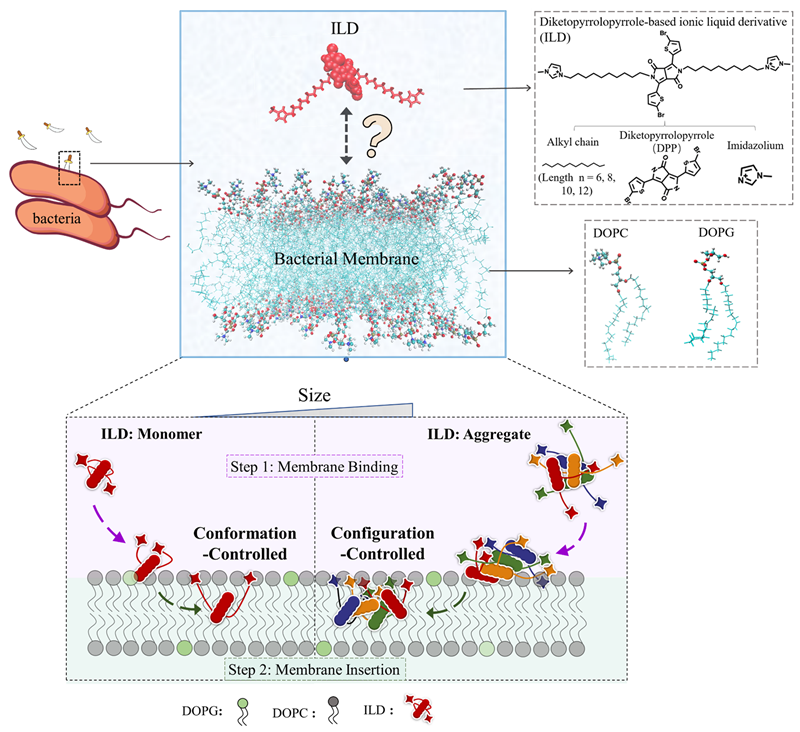
图 1. 离子液体对膜的攻击。上:离子液体和膜脂质的分子结构;下:离子液体与膜相互作用的两步机制:(1)初始膜结合,随后(2)插入,同时离子液体单体(分子内)发生构象变化,离子液体聚集体(分子间)发生构型变化。
二、从机理到设计:未来抗菌剂的理性设计新策略
这一新的机理认知,不仅解决了基础科学问题,更直接转化为可行的抗菌剂设计策略。
1. 精准调控链长与浓度: 设计者不再需要盲目寻找“最优链长”,而是可以根据预设的应用场景(如药物浓度),通过调控链长来精确控制ILDs是以高效结合的单体形式存在,还是以强力破坏的聚集体形式存在,实现“按需设计”。
2. 引入结构“骨架”进行预组织: 既然聚集体的构型熵至关重要,那么可以通过引入结构调控剂(如本研究中验证的C60富勒烯)作为“骨架”,在溶液中就将ILDs“预组织”成高效的攻击构型。这能大大提升其膜结合效率,实现“1+1>2”的效果。
3. 发展智能响应材料: 未来的ILDs可以被设计成“智能”分子。例如,在其链上引入光敏或pH敏感基团,使其在正常体液中保持温和的单体状态,一旦到达酸性的感染病灶或经光照激活,便迅速转变为高活性的聚集体状态,从而实现对病灶的精准、高效打击。
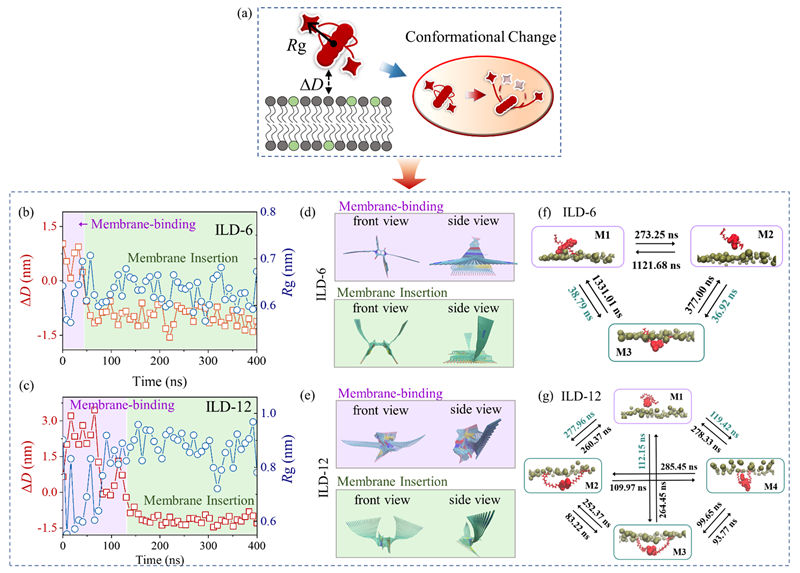
图 2. 单体ILD(ILD-6 和 ILD-12)在膜攻击过程中的构象变化。(a)描绘ILD-膜分离距离(∆D)和回转半径(Rg)的示意图。(b,c)ILD-膜相互作用过程中∆D 和 Rg 的时间演变。(d,e)通过主成分分析(PCA)确定的ILD 分子在膜结合和插入步骤中的优选构象,突出显示了ILD 分子的第一主成分和 20 个代表性分子构象。(f,g)通过马尔可夫态模型(MSM)和平均首次通过时间(MFPT)分析的ILD 分子的优选构象及其之间的转换。棕色珠子代表上层膜脂质头部基团。紫色和绿色框分别表示膜结合和插入步骤。
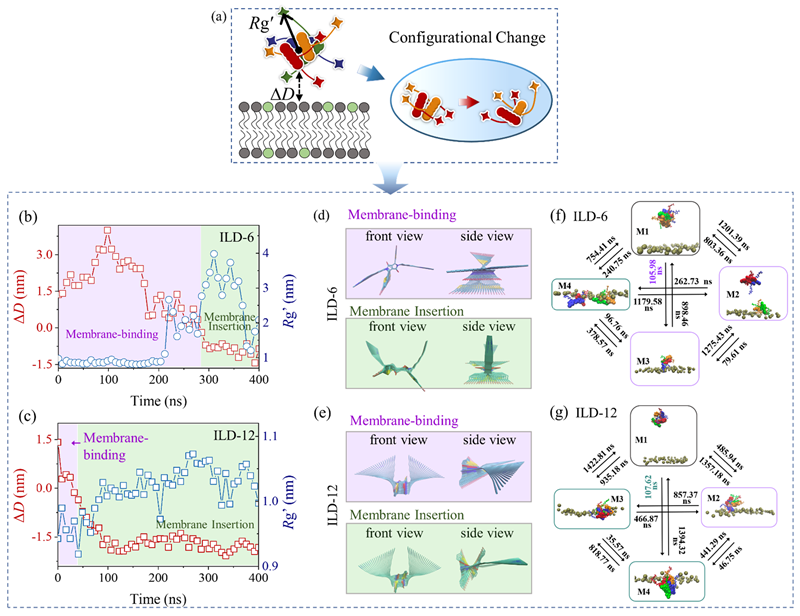
图 3. 聚集态 ILD(ILD-6 和 ILD-12)在膜攻击过程中的构象变化。(a)展示聚集态与膜之间的分离距离(∆D)以及聚集态的均方根半径(Rg')的示意图。(b,c)ILD 与膜相互作用过程中 ∆D 和 Rg' 的时间演变。(d,e)通过主成分分析(PCA)确定的膜结合和插入步骤中聚集态内单个 ILD 分子的优选构象,重点关注第一主成分和 20 种代表性分子构象。(f,g)通过马尔可夫态模型(MSM)和平均首次通过时间(MFPT)分析的 ILD 聚集态的优选构象及其之间的转换。棕色珠子代表上层膜中的脂质头部基团。紫色和绿色框分别表示膜结合和插入步骤。
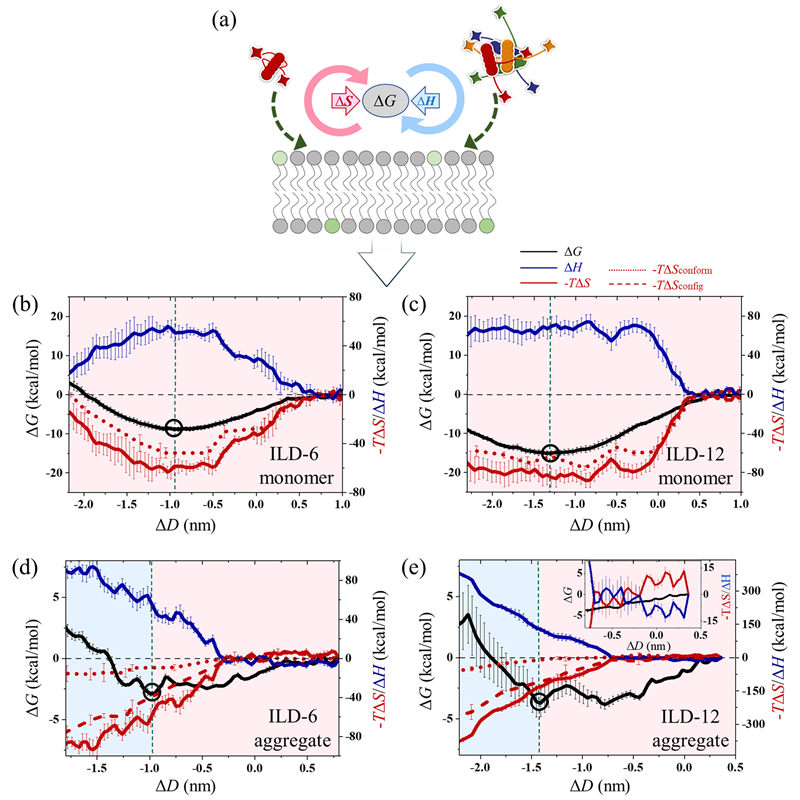
图 4. ILD与膜相互作用中的熵焓竞争。(a)熵(-TΔS)和焓(ΔH)对自由能(ΔG)的贡献竞争示意图。(b、c)单体ILD与膜相互作用时,ΔG、ΔS(包括构象熵∆Sconform和构型熵∆Sconfig)和ΔH随ΔD的变化情况。注意单体的∆Sconfig = 0。(d、e)相应聚集态ILD与膜相互作用的热力学变化。圆圈表示ΔG的最小值;(e)中的插图显示了ILD-12 聚集体初始膜结合曲线的放大视图。背景颜色方案表示主导机制:红色(熵驱动)和蓝色(焓驱动)。
三、总结与展望
该研究系统阐明了离子液体衍生物的烷基链长如何通过调控熵(构象熵 vs. 构型熵)来决定其膜攻击机制,为该领域长期存在的争议提供了统一的物理解释。这些发现为理性设计新一代能够克服耐药性的高性能抗菌剂提供了新的理论平台和清晰的实践路径,在应对慢性炎症、自身免疫性疾病乃至肿瘤免疫治疗等领域也展现出潜在应用价值。
相关研究成果以“Conformational versus Configurational Entropy: Deciphering the Alkyl Chain-Dependent Membrane Attack Mechanism of Ionic Liquid Derivatives”为题,近日发表在学术期刊 ACS Nano上。论文第一作者尤鑫是苏州大学与松山湖材料实验室纳米生物材料团队联培实习生。
文章链接
https://pubs.acs.org/doi/full/10.1021/acsnano.5c10093
