科研进展丨智能“pH开关”脂质体纳米颗粒,赋能红细胞冷冻保存难题
【引言】
每当提及“熊猫血”或稀有血型,我们都会意识到血液资源的宝贵。为了应对突发事故和临床需求,建立一个稳定、长效的血液库至关重要。然而,如何让珍贵的红细胞“安然冬眠”数年乃至数十年,并在需要时被安全唤醒,一直是输血医学领域面临的重大挑战。
1.传统冷冻保存方法的局限性
目前,临床上广泛应用的红细胞冷冻保存技术依赖于高浓度甘油作为低温保护剂。该方法虽可实现长达十年的有效存储,但其应用受到固有缺陷的制约:甘油对细胞具有一定毒性,因此在输血前必须经过一套繁琐、耗时的脱除程序。此过程不仅增加了仪器成本、操作成本和细胞损耗的风险,更重要的是,它显著延长了冷冻血液从出库到应用的准备时间,限制了其在紧急情况下的快速响应能力。
为克服这些局限,研究人员将目光投向了一种天然糖类——海藻糖。作为一种性能优异的生物相容性保护剂,海藻糖安全无毒,理论上无需在输注前去除。然而,实际应用中的一个核心障碍是,红细胞缺乏有效的内吞途径,导致非渗透性的海藻糖分子难以进入细胞内部以发挥其保护作用。因此,开发一种能够高效、安全地将海藻糖递送至红细胞胞质内的策略,是推动该技术发展的关键。

2.源于mRNA疫苗技术的递送新策略
针对上述挑战,松山湖材料实验室纳米生物材料团队魏裕双副研究员、元冰研究员联合苏州大学杨恺教授及东莞市人民医院罗北京医生,借鉴了mRNA疫苗递送技术中的核心机制,成功设计并构建了一种可冻干的离子型脂质纳米颗粒(LNP)平台,为红细胞的低温保存提供了一种新的解决方案。
该技术的核心在于LNP的智能pH响应特性。在生理pH(7.4)环境中,LNP呈电中性,与红细胞相互作用较弱。当环境变为温和酸性(pH 6.5)时,LNP表面的离子型脂质发生质子化,使其表面带上正电荷。这随即引发其与带负电荷的红细胞膜之间的静电相互作用,并促进二者发生直接的膜融合。通过这一过程,LNP所包裹的海藻糖得以被高效地释放到红细胞的胞质中。
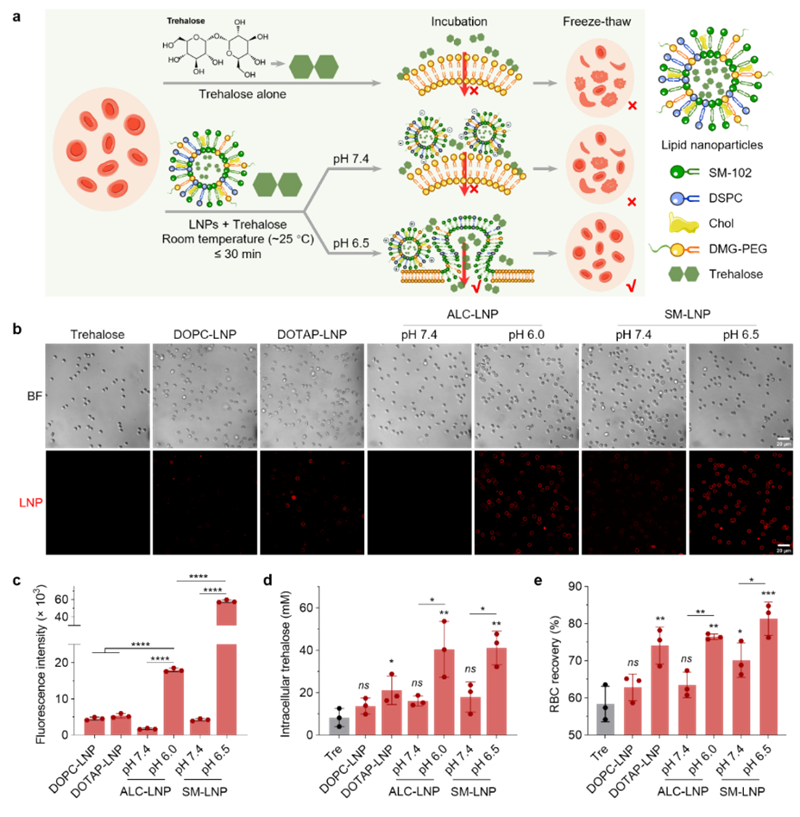
图1. 不同脂质纳米颗粒介导的红细胞融合与冷冻保存。(a) 示意图。上:海藻糖自身难以跨越细胞膜屏障进入红细胞;中、下:包载了海藻糖的脂质体纳米颗粒,在pH 7.4下无法实现有效递送,在pH 6.5下发生膜融合、将海藻糖有效递送至红细胞内部和实现安全冻存。(b-e) 红细胞在 37°C 下与 DOPC-LNPs 或 DOTAP-LNPs(pH 值为 7.4)或 ALC-LNPs(pH 值为 7.4 和 6.0)以及 SM-LNPs(pH 值为 7.4 和 6.5)孵育 1 小时。展示了冷冻保存后回收的红细胞的共聚焦图像。红色荧光,脂质纳米颗粒。比例尺,20 微米。(b-d),与(a)相对应的红细胞荧光强度(b)、细胞内海藻糖(c)和恢复率(d)。
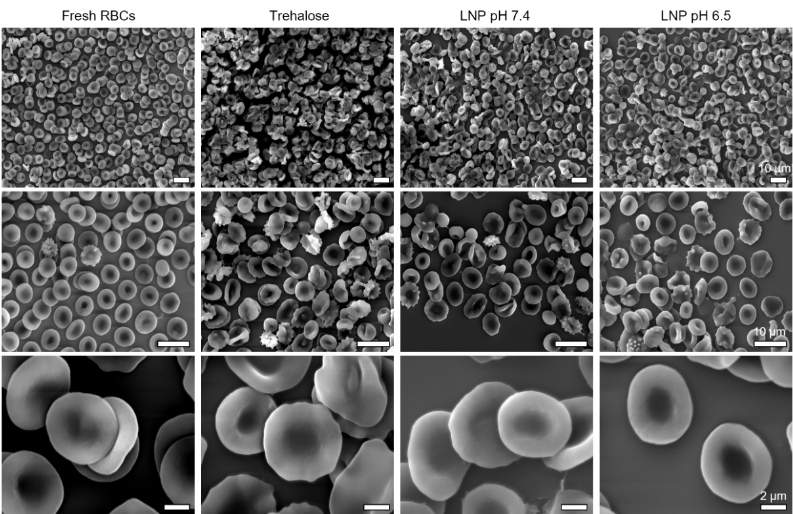
图2. 扫描电子显微镜(SEM)图像展示了不同方法冷冻保存后红细胞的形态。仅用海藻糖溶液冷冻保存的红细胞(左2列)出现了明显的变形和损伤,而经由LNP (pH 6.5)技术保存的红细胞(右1列)在冻融后,仍保持了健康的双凹盘状结构;LNP (pH 7.4)策略效果略差(右2列)。
3.研究亮点与应用前景
该研究工作在红细胞低温保存领域取得了显著进展:
(1)高回收率与简化的操作流程:通过系统优化LNP的脂质组成与制备工艺,该方法实现了高达85%的冻融后红细胞回收率,其保护效果与传统甘油法相当。同时,其操作流程显著简化,仅需短暂的室温孵育和单次离心步骤,大幅缩短了临床前处理时间。
(2)可冻干制剂实现长期稳定:该研究成功将LNP/海藻糖制剂冻干成稳定的固体粉末。这一形态不仅解决了LNP水溶液长期储存稳定性不足的问题,也为制剂的运输和分发提供了便利,显著增强了该技术的实用性。
4.未来展望
这项研究系统性地阐明了pH响应性LNP与非内吞细胞的直接膜融合机制,为输血医学领域提供了一个具有应用潜力的技术方案。同时,该策略也为其他类型细胞(如干细胞、免疫细胞等)的低温保存技术开发,以及更广泛的药物靶向递送研究提供了新的思路。
该工作近日已发表于期刊Advanced Healthcare Materials,纳米生物材料团队工程师李向阳为论文第一作者,松山湖材料实验室为论文第一单位。
原文链接:https://doi.org/10.1002/adhm.202502455
